La Química y la Ciencia.
La Química y la Ciencia.La Ciencia es el conocimiento obtenido a través del llamado método científico.
El método científico es un modo natural, ordenado, racional y sistemático de obtener el conocimiento.Este modo comienza con la observación de un fenómeno, continúa con la formulación de hipótesis que intentan explicar lo observado, prosigue con los experimentos que permiten confirmar y descartar las hipótesis. Como resultado de las actividades descritas se obtienen conocimientos particulares que se expresan mediante las leyes científicas .
La Materia y las Sustancias Puras

Concepto de Molécula y sustancia Pura
Una molecula es un conjunto de átomos iguales o diferen tes , unidos por enlaces químicos , que constituyen la minima porción de una sustancia.
Una Sustancia Pura es un conjunto de moléculas idénticas, de igual tamaño, masa, y forma.
Los cambios de tipo físico de una sustancia pura nos muestran la necesidad de considerar el aspecto propiedades de los sistemas materiales. Esto es, si bién se trata del mismo tipo de moléculas , las propiedades (color, densidad, viscosidad, temperatura, etc. ) del sólido difieren de las del líquido y éste de las del gas.
¿ Que es una Fase ?
Una fase es una porción de materia que posee idénicas propiedades, tanto fisicas como químicas,en toda se extensión.Una Sustancia Pura puede ser una fase sólida o una fase líquida o una fase gaseosa dependiendo de la temperatura a la que se encuentre. Durante el cambio de estado coexisten dos fases a la temperatura de la transición correspondiente.
A una determinada presión y a una determinada temperatura, una Sustancia Pura puede presentar coexistencia (existencia simultánea) de tres fases como representa el gráfico a continuación.


Sistemas Materiales
Un sistema material es cualquier porción de materia. Podemos entenderlo por extensión como sustancia o material, es decir, toda la materia con las mismas características, o en particular como cuerpo u objeto, es decir, una parte concreta de la materia.
-Sistemas Heterogeneos.
Es aquel sistema que en diferentes puntos del mismo tiene distintas propiedades físicas y quimeras . Presenta solución en su continuidad (superficie de separación).
Muchos sistemas heterogéneos, a simple vista aparentan ser homogéneos y su categoría se decide luego de un examen al microscópio.
 Tecnicas de separacion de fases para sistemas heterogenoes
Tecnicas de separacion de fases para sistemas heterogenoes-Filtración.
a)-Simple
b)-con succion o de vacio
-Decantación.
-Centrifugación.
-Sulimacón.
-Disolución.
-Tamización.
Sistemas Homogeneos
Es aquel sistema que en todos los puntos de su masa posee iguales propiedades físicas y químicas (mismas propiedades intensivas). No presenta solución en su continuidad ni aun con el ultramicroscopio.
-a) Sustancia Pura: Un solo tipo de moléculas.
-b)Solucion: Dos o más tipos de moleculas.
Tecnicas de separación de sustacias puras desde sistemas homogeneos.
-Destilación.
-Extraccion por solventes.
-Cristalización.
-Cromatografía.
LAS SUSTANCIAS PURAS: El cambio Químico y las leyes fundamentales.
Cuándo las Sustancias Puras reciben energía mayor que la necesaria para que acontezcan los cambios físicos sus moléculas se modifican, variando el tamaño, la masa y la forma, es decir se transforman en moléculas o Sustancia Puras distintas de las iniciales. En estos casos ha ocurrido un Cambio Químico o Reacción Química. Cambio Químico
Sustancia (s) Pura (s) Inicial (es) ---> Sustancia (s) Pura (s) Final (es)
Molécula (s) Inicial (es) ---> Molécula (s) Final (es)
Reaccionante (s) ---> Producto (s)
Algunas moléculas se rompen en fragmentos o degradan con relativa facilidadad,Estas últimas sustancias de difícil ruptura o degradación se consideran fundamentales y se les denomina Elementos y con ellas se formarían aquellas más complejas y que se les denomina Compuestos.
Ley de conservación de la Materia (Lavoisier)
En un cambio químico la masa de los reaccionantes es igual a la masa de los productos.
Ley de las proporciones definidas (Proust)
La proporcion en que los elementos se combinan para formar compuestos es definida o constante no importando la procedencia del compuesto.
Ley de las proporciones multiples ( John Dalton)
Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros.
MODELO ATÓMICO
Las leyes fundamentales recién estudiadas demuestran que las moléculas a su vez están formadas por otras partículas aún más pequeñas. Estas nuevas partículas se denominan átomos ydeben poseer las siguientes cualidades:
1.- Los átomos son partículas, que mediante fuerzas denominadas enlace químico , se unen para formar las moléculas.
2.- Cada elemento tiene un átomo característico, es decir , de tamaño y masa determinados. Existen tantos tipos de átomos como de elementos. ( Los Elementos son aquellas Sustancias que mediante Símbolos se presentan en el Sistema Periódico)
3.- Si los átomos se presentan solitarios, o bien unidos del mismo tipo, se trata de moléculas de un Elemento.
Si los átomos se presentan unidos, de distinto tipo, se trata de moléculas de un Compuesto.
4.- Un Cambio Químico es un reordenamiento de átomos.
Los elementos y los compuestos.
Análisis de Sustncias puras
El análisis qímico cualitativo comprende la separación e identficación de los elemento que forman un compuesto mientras que el análsis químico cuantitativo comprende la medicion de la cantidad de cada uno de los elemetos que forman el compuesto.
Nomeclatura química
- Un átomo de un elemento se representa por un símbolo.
- Una molécula de una sustancia pura se representa por su formula.
- Un reordenamientode átomos de un cambio químico se representa por su ecuación.
Ley de Volumenes de combinación de gases( Gay Lussac )
Los volumenes de gases de Reaccionantes y Productos, medidos en iguales condiciones de Presión y Temperatura, están en relación de números enteros.
Hipótesis o pincipio de avogrado

Se debe a AVOGADRO la reconciliación entre los hechos experimentales, ley de Gay-Lussac, y la teoría atómica, al sugerir en 1811 lo que hoy conocemos como hipótesis de Avogadro.
En volúmenes iguales de todos los gases, medidos en las mismas condiciones de presión y temperatura, existen igual número de moléculas.
Estudio de los Átomos.
La materia y la electricidad.
Distintos experimentos demuestran la existencia de dos tipos de electricidad.
- Electricidad Positiva
- Electricidad Negativa
Cuerpos con cargas iguales (+,+ o -,-) se repelen, cuerpos con cargas de distinto signo se atraen(+,- o -,+).
- Faraday determino la proporcionalidad entre las sustancias transformadas y la cantidad de electricidad empleada.Surge así la nociòn de que la corriente electrica es un flijo de párticulas a las que se les llamo electrones.
- Thompson demuestra la existencia de electrones , usando el tubo de rayos catódicos.
- Millikan determina la carga eléctrica del electrón en su clásico experimento de la gota de aceite.

(Experimento de Milikan)
Las Particulas intratomicas Fundamentales
- Rutherford, realiza un experimneto en donde bombardea una lamina de oro con rayos a (particulas pesadas cargadas positivamente), y atraves del cual conluye que la lámina de oro es prácticamente vacía, o mejor, el átomo de oro concentra toda su masa en un núcleo de carga positiva de volumen muy pequeño en relación al volumen atómico total.
Comprende la presencia en el núcleo del átomo, de los protones, partículas cargadas positivamente y de masa mayor que la del electrón y que ya habían sido detectadas con el tubo de Thompson. También se comprende la presencia en el nucleo de los neutrones, partículas de igual masa que el protón pero sin carga eléctrica.
El nucleo, por la presencia de los protones, tiene carga positiva y por esta razón atrae los electrones (cargas negativas) que giran a su alrededor en órbitas semejantes, en una primera aproximación a las órbitas planetarias del sistema solar.
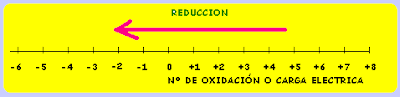
Nomenclatura para sistemas atòmicos y sus modificaciones
(NUMERO MÁSICO CARGA) ( ELÉCTRICA O ESTADO DE OXIDACIÓN)
SÍMBOLO
Donde:
- Número átomico = Número de Protones
- Número Másico = Número de Neutrones + Número de Neutrones
- Carga electrica = Número de Protones - Número de electrones
Otras Definiciones :
- Ión: Átomo o grupo de átomos cargados electricamente.
- Isótopos: Son átomos de igual Z pero distinta A.
- Isóbaros: Son átomos de distinto Z pero de igual A.
Determinación de los pesos átomicos
La existencia de isótopos (átomos de distinta masa) en todos los elementos debe ser tomada en cuenta cuando se trata de determinar las relaciones de los pesos de los átomos. En la actualidad es posible conocer los distintos tipos de isótopos que presenta un elemento en su estado natural y además es posible saber en que proporción o cantidad se encuentran gracias a la tecnología del espectrógrafo de masas.

 El espectografo de masases un aparato en que por descargas eléctricas los átomos de un elemento se transforman en iones positivos. Estos iones son conducidos a la forma de un haz lineal hasta una zona en que son desviados mediante dispositivos magnéticos o eléctricos de acuerdo a la masa del ión ( los iones más pesados se desvían menos ). Así los iones en diferentes haces según su masa son detectados y cuantificados.
El espectografo de masases un aparato en que por descargas eléctricas los átomos de un elemento se transforman en iones positivos. Estos iones son conducidos a la forma de un haz lineal hasta una zona en que son desviados mediante dispositivos magnéticos o eléctricos de acuerdo a la masa del ión ( los iones más pesados se desvían menos ). Así los iones en diferentes haces según su masa son detectados y cuantificados. El Peso Atómico relativo se calcula de la siguiente manera:
A r = A1 * X1 + A2 * X2 + .............
Donde los A i son los Números Másicos o bién la masa en Unidades de Masa Atómica ( u.m.a.) de los distintos Isótopos y los X = % abundancia / 100

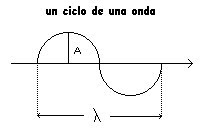
l(lambda)= longitud de onda
T= Periodo
v(nu)=fracuencia
El espectro continuo de las ondas electromagneticas

Fisica Clasica V/S Fisica Moderna.
Segun la fisica clasica la energia era de Naturaleza continua y la energia de una onda electromagnetica era proporcional a la ampliud de la onda.
La fisica moderna por el contrario aclara que la energia es de caracter discontinuo , se representa a traves de pequeños paquetes de energia , los cuales se denomina cuantos cuantas o FOTONES y la energia de una onda electromagnetica es proporcional a su frecuencia.
La energoa de un foton esta dada for la formula h.v
Donde:
h= Constante pe Planck 6,62 10 -27 erg. seg
v= frecuencia.
El atomo de Hidrogeno de BOHR

radio de las orbitas= r
Energia del electron= E
Energia asociada a los cambios de orbita.

E foton absorbido= E final- E inicial.
E foton emitido= E inicial - E final.
La meanica cuantica ondulantoria

Orbital= zona de alta probabilidad de encontrar una particula.
Los numeros cuanticos
n= Numero cuantico principal
se relaciona con la tamaño y energia de los orbitales.
infinitos valores.
l= Numero cuantico secundario
Se asocia al tipo o forma de los orbitales.
¿Cuantos valores? =n
estos son:
m= numero cuantico mágnetico este se relaciona con la orientacion espacial de los orbitales cuantos valores ? 2l+1
s= numero cuantico de spin electronico se asocia al jiro del electron sobre su eje.
Graficos de los orbitales


No puede haber 2 electrones con los cuatro numeros cuanticos iguales. es como decir que un orbital acepta un maximo de dos electrones.
Regla de Ta o de las diagonales.

Los electrones se ubican primero em los orbitales de menor energia.
- son de menor energia los de menor valor n+1
- a igualdad de n+1 se considera de menor energia los de menor n.
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.
PROPIEDADES MAGNETICAS DE LAS SUSTANCIAS
Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos. Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.
Electrones de valencia
Son aquellos que se encuentran en los orbitales de mayor numero cuantico principal , más aquellos que estan en orbitales con el numero cuantico principalanterior al mayor a condicion de estar incompletos.
Sistema periodico d elos elementos

IV UNIDAD
Propiedades periodicas de los elementos
La repeticion de las configuraciones electronicas y la formacion de un sistema periodico y grupos , es el fenomeno de caracter periodico màs relevante . Por otra parte, hay otras propiedades atómicas importantes afectadas de caracter periodico.
El radio Atomico
El radio atomico representa la distancia que existe entre el nùcleo y el electron periferico.
- El radio atomico disminuye suavemente al aumentar z en un periodo.

- El radio atomico aumenta bruscamente al aumentar z en grupo o familia.los electrones perifericos se encuentran en un otbital del mismo tipo pero en el nivel siguiente

Los iones son atomos cargados electricamente qu eresultan de ganar o perder electrones. el radio de los iones es diferentes al d elos atomso neutros. los iones negativos( ganan electrones) son de mayor radio , en acambio ,los positivos ( pierden electrones) son de menor radio .
radios atomicos y radios ionicos

Potencial de Ionización.
Es la energia que se necesita para arrancar el electron periferico de un atomo neutro libre.
Mientras mas cercano al nucleo el electron periferico es atraido con mayor fuerza y viceversa. En consecuencia la magnitud de la energia de la ionizacion se comporta en forma invresa a la del radio atomico.
La electroafinidad
Es la energia que se libera cuando un atomo libre y neutro captan u electron.
Mientras más cercano al nucleo, ele elctron periferico es atraido con mayot fuerza y viceversa. En consecuencia la magnitud de la electroafinidad se comporta en forma inversa a la del radio atomico.
La electronegatividad
La Electronegatividad es una magnitud que engloba tanto al P.I como a la E.A. y, en consecuencia, es proporcional a ambas. De la misma forma que las magnitudes anteriores se comporta en forma inversa al Radio Atómico.
Mide la tendencia a formar iones negativos o bien la capacidad de atraer electrones.
La electropositividad
La Electropositividad es una magnitud de sentido inverso de la E. N.
Mide la tendencia a formar iones positivos o bien la capacidad de perder, ceder o repeler electrones.
La formacion de los iones
Las propiedades periódicas recién estudiadas y sus variaciones en el ordenamiento del Sistema Periódico apuntan a un hecho de singular importancia para el comportamiento químico de los distintos elementos. Esta es la situación de estabilidad, sinónimo de baja energía, de los sistemas electrónicos de los gases nobles. Estos sistemas tienen sus orbitales comprometidos, completos de electrones. La circunstancia que las moléculas de gases nobles son monoatómicas son la prueba de tal estabilidad, es decir, los átomos de los gases nobles no realizan intercambios electrónicos ni para formar iones ni para unirse con otros átomos pues sus configuraciones electrónicas son estables.
La formacion de las moleculas
La formación de los iones o bién alcanzar ciertos estados de oxidación hay que observarlo como un proceso asociado entre distintos átomos y que conduce a la formación de las moléculas de las diferentes Sustancias Puras. Las fórmulas (atomicidades) de aquellas moléculas puede deducirse teniendo en cuenta el estado de oxidación de los iones estabilizados y fundamentalmente la necesidad que la estructura molecular resultante sea eléctricamente neutra. La atomicidad de un elemento se obtiene tomando en primer término el valor absoluto del estado de oxidación del átomo del otro elemento y viciversa, luego aquellas atomicidades se simplifican, de ser posible, llegándose a las definitivas.
Tipos de compuestos fundamentales
- Oxidos no metalicos ( antes anhidricos)
- Los hidroxidos ( oxidos metalicos + agua )
- Los oxacidos ( Oxido no metalici mas agua )
- Los hidracidos ( Hidrogeno + no metales )
- Los acidos y la Bases
. Los acidos son sustancias de formula general HA que se disocian en el agua liberando el ion hidrogeno.
. La bases son sustancias de fórmula general BOH, que se discocian en agua liberando el ion hidroxilo
-La Sales ( resultado de la reaccion de acidos + bases )
- Los hidruros ( iones metalicos con iones hidruros)

UNIDAD V
El enlace quimico es la fuerza que une a los atomos para formar moleculas. Es un proceso de estabilizacion por interacciones electronicas donde cada atomo trata de aslcanzar la configuración electronica del gas noble más cercano.
La energia de estrabilizacion se donomina también "energía de enlace" y corresponde también a la energía liberada cuando se forma el enlace a la energía necesaria para romper dicho enlace.

Electrones de valencia: Son aquellos que se encuentran en los orbitales de mayor número cuantico principal más aquellos que se encuentran en orbitales con el n´pumero cuántico principal anterior del mayor a condicioón de estar incompletos.
Notacion de Lewiis:

Tipos de enlaces
Los que cumplen la regla de Octeto.
- Enlace Ionico: Cesión d electrones, de parte de un átomo fuertemente electropositivo a otro fuertemenete electronegativo. Formación de Iones positivos y negativos y atracción electrostática entre ellos.
- Enlace Covalente: Compratcición de parejas de electrones entre átomos de parecida o igual electronegatividad Electrones compartidos con con spines opuestos y atracción mágnetica.

El enlace quimico y la mecánica cuantica.
La mecanica cuantica contempla la combinación matematica de las funciones de onda de orbitale s atomicos para dar orbitales moleculares . La combinacion produce dos orbitale smoleculares.
- La suma de funciones atomicas de un orbital molecular enlazante donde se sitúa la pareja de electrones con spines opuestos . Este se puede visualizar como la superposición de los orbitales atómicos. En el grafico siguiente se muestra la energía de éste orbital molecular en función de la distancia internuclear. Existe una estabilización a medida que los átomos se acercan pues predominan las fuerzas de atracción entre los atomos sin embargo si los átomos se acercan demasiado hay una desestabilización producto de fuerzas de repulsión interatómica. La menor energía corresponde a un pozo de energía en que se encuentran los átomos en equilibrio respecto de las atracción y la repulsión interatómicas. Este pozo de energía determina la distancia internuclear llamada también longitud de enlace.
- La diferencia de funciones atómicas genera un orbital molecular antienlazante marcado por fuerzas de repulsión en donde la la mayor estabilidad se alcanza cuando los átomós están separados a gran distancia. En este orbital los electrones se encuentran con spines paralelos. Corrresponde al proceso de ruptura d el enlace.
Tipos de Uniones

Unión s (sigma)
Orbital Molecular enlazante con superposición de orbitales atómicos sobre linea internuclear
Combinación de orbitales atómicos p.

p (pi)
Orbital Molecular Enlazante con superposición de orbitales atómicos fuera de linea internuclear.

GEOMETRÍA MOLECULAR
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos (mezcla matemática de funciones de onda).
Existen diferentes formas de hibridación y la forma que en definitiva adopte un átomo decidirá la orientación espacial de sus orbitales y por consecuencia la GEOMETRIA MOLECULAR
Cuando existen solamente uniones s la hibridación se determina sólo en base del criterio de repulsión de parejas.
Dos parejas de electrones la hibridación es sp , tres parejas de electrones la hibridación es sp2 y cuatro parejas de electrones la hibridación es sp3 .

Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
El enlace covalente es el más fuerte, lo sigue el iónico y finalmente el metálico que es el más débil
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
COVALENTES TRIDIMENSIONALES
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
COVALENTES BIDIMENSIONALES
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pz existen un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.
COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadas polímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Los homopolímeros que repiten unidades iguales (-A-A-A-A-A-A- ; -(A)- n ).
Los copolímeros que repiten unidades distintas ( A-B-A-B-A-B- ; ( -A-B-) n ).
Los polímeros flexibles o plegables forman estructuras sólidas bifásicas (cristalinas – amorfas) que son quebradizas, éstas estructuras se pueden disolver o fundir con relativa facilidad pues cuando alcanzan tales estados la macromoléculas están muy enroscadas, plegadas u ovilladas, en suma desordenadas lo que favorece el proceso de separación de las macromoléculas.

En cambio, las macromoléculas rígidas no tienen favorable el factor entrópico y así son dificiles de fundir y solubilizar. Estos polímeros rígidos, en el sólido son monofásicos y de mucha resistencia ( Kevlar).
IONICAS



En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.
METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.
Ya nos hemos referido a la fortaleza del enlace metálico y podemos generalizar diciendo que los puntos de fusión de los metales son medianamente altos. La naturaleza de movilidad del enlace metálico confiere a los metales su blandura, es decir los convierte en dúctiles y maleables.
La movilidad de los electrones se traduce en la capacidad de conducción de la corriente eléctrica y también es responsable de la conductividad térmica.
MOLECULAS CONVENCIONALES
O SUSTANCIAS MOLECULARES
Son aquellos sistemas formados por moléculas que se encuentran claramente definidas, se conoce el número exacto de átomos y de qué elementos está constituída la molécula. Se representan por las llamadas fórmulas moleculares reales.
En su gran mayoría las moléculas de ésta categoría unen sus átomos con enlaces covalentes y al expresar esto pensamos en muchas moléculas simples formadas entre no metales y en la inmensa cantidad de compuestos orgánicos constituídos principalmente por los elementos C, H, O, N, P, S.
En los comentarios generales cabe señalar que estos sistemas no conducen la corriente eléctrica en ningún estado físico y también son malos conductores del calor.
Las fuerzas de Van der Waals son comparativamente las fuerzas intermoleculares de menor intensidad pero pueden existir grandes diferencias de sus magnitudes entre moléculas que las poseen como único factor de atracción.
Estas diferencias pueden ocasionarse por :
a) por significativa diferencia del tamaño de las moléculas.
b) por la presencia de átomos de mucha diferencia en la cantidad de electrones o de muy distinta polarizabilidad electrónica.
c) por la circunstancia de presentar una geometría muy diferente.
fUERZAS INTERMOLECULARES
| TIPO MOLECULAR | FUERZA | MAGNITUD | FENÓMENO | SOLUBILIDAD | PUNTO DE FUSIÓN Y EBULLICIÓN |
| APOLAR | VAN DER WAALS | DEBIL | POLARIZABILIDAD ELECTRONICA | SOLVENTE APOLAR | MUY BAJOS |
| POLAR | ATRACCIÓN DIPOLO-DIPOLO | MEDIANA | POLARIDAD MOLECULAR PERMANENTE | SOLVENTE POLAR | BAJOS |
| ____ X - H ( X= F, O, N ) | PUENTE HIDROGENO | FUERTE | POLARIDAD PERMANENTE LOCALIZADA | SOLVENTE POLAR | MEDIA |

Unidad VII
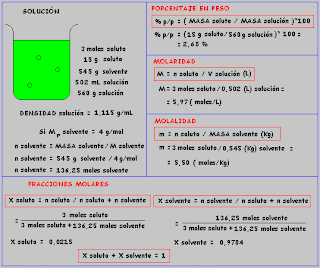
Dada cualquier sustancia (elemento químico, compuesto o material) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como atomos hay en 12 gramos de carbono 12. Esta definición no aclara a qué se refiere con cantidad de sustancia y su interpretación es motivo de debates, aunque normalmente se da por hecho que se refiere al número de entidades.
El número de unidades elementales –atomos, moleculas ,iones,electrones ,radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada numero de Avogadro (N) y equivale a:
N = 6,023 .10 23
El peso atomico
El Peso Atómico de un elemento ( A r ) es la masa de un mol de atomos de tal elemento expresada gramos.
Sus unidades de medida son por consiguiente gramos/ mol de atomos

Un mol de moleculas de cualquier gas medido en TPE. ocupa un volumen de 22,4 litros
- Sus unidades de medidas seran por consiguiente gramos/ mol de moleculas

El calculo del peso Molecular
Si una Sustancia tiene por Fórmula AaBbCc........
A nivel submicroscópico su molécula está formada por a átomos de A, b átomos de B y c átomos de C etc...
y a nivel macroscópico el mol de moléculas está formada por a moles de átomos de A, b moles de átomos de B y c moles de átomos átomos de C etc... y de allí que el Peso Molecular se calcule con la siguiente fórmula.
Mr AaBbCc........ = a * Ar A + b * Ar B + c * Ar C +........
¿Cuánto vale el Peso molecular del Cloroformo CHCl3?
Mr CHCl3 = 1 *12 + 1 * 1 + 3 * 35,5 = 119,5 g/mol
También podemos generalizar importantes conceptos acerca de un doble significado, a nivel submicroscópico y a nivel macroscópico, de la notación química de Símbolos, Fórmulas y Ecuaciones.
Presentaremos este doble significado valiéndonos de representaciones gráficas para las entidades submicroscópicas y las representaciones gráficas ampliadas para los conceptos (de moles) usados a nivel macroscópico.
Unidad VIII
UNIDAD IX





























.PNG)
.PNG)
.PNG)